 проволку,
то серебро, нагреваясь, испаряется. У платины температура плавления и
електропроводность выше, чем у серебра, поэтому молекулы серебра улетают с
поверхности платиновой проволки, которая только нагревается, но не плавится.
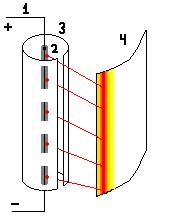
Если эту проволку поместить в два циллиндра таких, что меньший ( 3 ) имеет
тонкую прорезь и содержится в большем ( 4 ). Тогда честь молекул серебра
проходящая через прорезь будет оседать на внешнем циллиндре, а остальные будут
оседать на внутреннем циллиндре. Получится полоска из серебра на внешнем
циллиндре. Если мы проведём такой опыт при врашающихся циллиндрах, то полоска
серебра будет немного сдвинута в сторону, противоположенную стороне вращения.
проволку,
то серебро, нагреваясь, испаряется. У платины температура плавления и
електропроводность выше, чем у серебра, поэтому молекулы серебра улетают с
поверхности платиновой проволки, которая только нагревается, но не плавится.
Если эту проволку поместить в два циллиндра таких, что меньший ( 3 ) имеет
тонкую прорезь и содержится в большем ( 4 ). Тогда честь молекул серебра
проходящая через прорезь будет оседать на внешнем циллиндре, а остальные будут
оседать на внутреннем циллиндре. Получится полоска из серебра на внешнем
циллиндре. Если мы проведём такой опыт при врашающихся циллиндрах, то полоска
серебра будет немного сдвинута в сторону, противоположенную стороне вращения.Рассмотрим каr движутся молекулы при опыте. Здесь установка находится в покое:

А тут установка движется. ( На рисунке молекулы движется относительно установки ):

Зная смещение нетрудно сосчитать среднюю скорость движения молекул. Но опыт показал, что во втором случае пятно на втором цилиндре больше по площади, чем в первом случае. Это свидетельствует о том, что все молекулы движутся с разными скоростями. Поэтому говорят о наивероятнейшей скорости движения молекул. Например наивероятнейшая скорость молекул воздуха при 0оС û 485 м/с, Водорода при нормальных условиях û 2000 м/с, кислорода û 500 м/с.
Этот опыт подтвердил распределение Максвелла молекул по скоростям.
 Он
предположил форму графика, на осях которого отложены скорость, и число моллекул,
имеющих скорость заданную в данном интервале отнесённое к произведению
полного числа молекул на скорость, заданную в данном интервале ( проще говоря по
одной оси скорость, а по другой отношение : DN / (N * DV)
где DN û
число моллекул имеющих скорость DV,
N û полное количество молекул ). Тогда выделив лубой
промежуток скорости DV,
плошадь под графиком будет DN / N
то есть доля молекул движущихся со скоростями в диапазоне
DV. Тогда, по
определению, самая высокая точка графика û наивероятнейшая скорость. Форма этого
графика зависит от температуры, поэтому при разных темпиратурах будет разная
наивероятнейшая скорость.
Он
предположил форму графика, на осях которого отложены скорость, и число моллекул,
имеющих скорость заданную в данном интервале отнесённое к произведению
полного числа молекул на скорость, заданную в данном интервале ( проще говоря по
одной оси скорость, а по другой отношение : DN / (N * DV)
где DN û
число моллекул имеющих скорость DV,
N û полное количество молекул ). Тогда выделив лубой
промежуток скорости DV,
плошадь под графиком будет DN / N
то есть доля молекул движущихся со скоростями в диапазоне
DV. Тогда, по
определению, самая высокая точка графика û наивероятнейшая скорость. Форма этого
графика зависит от температуры, поэтому при разных темпиратурах будет разная
наивероятнейшая скорость.